您好!歡迎訪問德爾塔儀器官方網站


gaoshengkeji@163.com

生物醫學工程是生命科學領域的一個相對較新但頗具前景的分支,其將材料、器械、設計和解決問題的工程與醫學和生物科學相結合,旨在改善診斷、植入、監測和治療等醫療治療效果。當前,心血管疾病嚴重威脅著人類身體健康,每年造成的死亡人數已超過1770萬人。近年來,植入材料及器械,特別是微創介入材料及器械,已成為治療心血管疾病的最有效的工具,如血管支架、藥物洗脫球囊、心臟瓣膜、心臟封堵器、人工血管、可注射抗心衰水凝膠和左心室輔助裝置等。
中國工程院院刊《Engineering》2021年第12期刊發四川大學王云兵教授的《心血管植入材料及器械的研究與進展》一文。文章探討了各種心血管植入材料和器械在有效治療心血管疾病中的應用,如血管支架、藥物洗脫球囊、心臟瓣膜、心臟封堵器、人工血管和可注射抗心衰水凝膠。文章指出,新型心血管材料和心血管微創介入技術的發展將為心血管疾病的治療提供強有力的解決方案。為尋求更優的治療方案,文章還指出了未來進一步研究的方向。
心血管疾病(CVD)是全球主要的死亡原因,每年造成的死亡人數已超過1770萬人。中國心血管疾病患者已達3.3億人,占疾病死亡總人數的43%以上,遠遠高于癌癥和其他疾病。冠心病(CHD)和結構性心臟病(SHD)是臨床常見的高風險心血管疾病。近年來,植入材料及器械,特別是微創介入材料及器械,已成為治療心血管疾病的最有效的工具,其中主要包括血管支架、藥物洗脫球囊、心臟瓣膜、心臟封堵器、人工血管、可注射抗心衰水凝膠和左心室輔助裝置(LVAD)等。
心血管支架和藥物洗脫球囊
與裸金屬支架(BMS)相比,藥物洗脫支架(DES)成功地降低了再狹窄(ISR)發生率,目前已廣泛用于冠心病(CHD)的治療。然而,長期臨床結果表明,DES仍存在晚期或極晚期血栓形成及再狹窄等不良并發癥發生的風險。DES涂層中抗增生藥物的局部釋放在抑制平滑肌細胞過度增殖的同時,也會引起內皮細胞愈合延遲,最終導致新生內膜表面內皮層不完整和內皮功能失調。血管支架的骨架材料及表面涂層的創新研究不斷推動著DES的發展。在表面涂層方面,研究人員目前專注于優化出具備更加理想藥物釋放的載藥涂層或開發可以模擬內皮細胞功能的新型涂層。對支架骨架材料而言,非降解支架的永久殘留會導致持續的炎癥反應,使血管難以恢復其生理脈動功能。由生物可吸收的聚合物或金屬制備的生物可吸收血管支架(BVS)具備促進血管功能再生恢復的潛力,成為DES的未來發展方向。目前關于BVS的研究集中在通過優化設計,獲得足夠徑向支撐強度、更小厚度及輪廓尺寸的支架筋結構。然而不容忽視的是,現有DES所采用的常規標準,如要求獲得盡可能薄的新生內膜,可能并不適用于BVS的設計。植入BVS后,如果新生內膜厚度過薄,支架降解破碎時,一旦有少量BVS碎片掉入血管,就有可能導致血栓形成等不良事件發生的風險。因此,在開發BVS時,應保證形成的新生內膜覆蓋支架植入部位,以便在降解過程中避免支架降解碎片脫落,并促進血管愈合。
除支架以外,針對DES的不足,藥物洗脫球囊(DEB)也是治療冠心病的手段之一。DEB無需使用支架,從而可以避免因支架使用帶來的各種潛在的不良事故發生。不過,盡管DEB在臨床上已取得了較好的效果,但由于球囊擴張時間較短(30~60 s),藥物從球囊表面輸送到管腔病變部位的效率通常較差。因此,迫切需要進一步優化設計藥物遞送新技術,以提高DEB的治療效果。
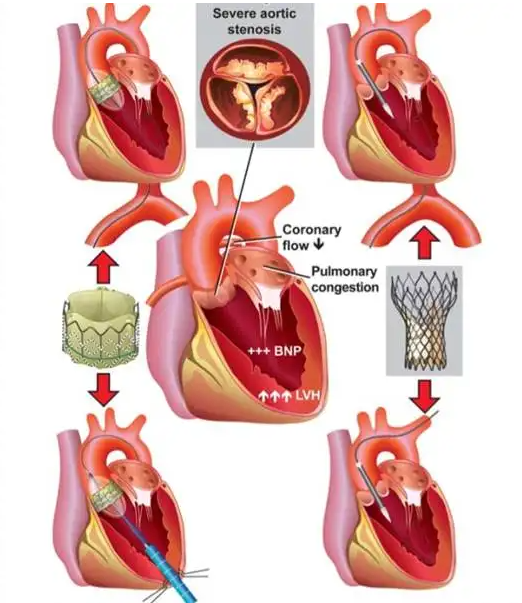
人工心臟瓣膜
心臟瓣膜疾病是一種常見的心臟疾病,人工心臟瓣膜置換術已成為治療該類疾病的最佳方案。近年來,心臟瓣膜置換手術的發展趨勢已由外科開胸手術向生物瓣膜微創介入手術轉變。目前商業化的生物心臟瓣膜大多由戊二醛處理的豬或牛心包等異種組織制成,但該類瓣膜存在毒性的醛基殘留,易發生瓣膜鈣化、微血栓形成、免疫排斥反應、內皮細胞黏附困難等缺陷,造成其使用壽命較短,僅有10年左右。此外,生物心臟瓣膜需浸泡在戊二醛溶液中的保存方式也進一步限制了其使用性能。
目前該領域的研究重點是通過更優的策略從根本上提升人工心臟瓣膜材料的綜合性能,其中包括:
①具有抗鈣化和抗血栓性能的戊二醛交聯瓣膜改性策略;
②生物相容性更優的新型非戊二醛交聯生物瓣膜;
③心臟瓣膜材料的干態保存;
④合成高分子瓣膜材料及低免疫原性的新型瓣膜材料。
目前人工瓣膜主要應用于主動脈瓣,預計將逐步擴展到肺動脈瓣、二尖瓣、三尖瓣和靜脈瓣等瓣膜的臨床使用。值得注意的是,在開發靜脈瓣膜時,需采用更為高效的抗凝策略,以克服靜脈瓣膜在使用過程中的高血栓形成風險。此外,利用細胞外基質材料和生物可降解合成材料制備的組織工程瓣膜,有望實現瓣膜的功能重建及瓣膜再生,也是未來重要的研究方向之一。
心衰治療
全球有超過2600萬比較嚴重的心力衰竭(心衰)患者,患者住院后5年內的死亡率高達42.3%。目前,心衰已成為全球人口死亡的主要原因。傳統治療心衰的手段主要包括藥物治療(如血管緊張素轉換酶抑制劑和利尿劑)和手術治療(如心臟再同步治療和左心室輔助裝置)。這些療法通常難以逆轉心肌壞死和心臟功能障礙,而僅是減輕心衰癥狀。心臟移植目前仍是恢復患者心臟功能的唯一有效的治療方法。然而,心臟捐獻者數量極其稀少,而且心臟移植手術復雜、難度高,限制了心臟移植在心衰治療中的應用。因此,迫切需要開發創新、有效的心衰治療新方法。
近年來,用于心衰治療的生物材料,由于其促進心肌組織再生和恢復心臟功能的特點,治療效果良好,受到越來越多的關注。用于心衰治療的生物材料主要為心肌補片和可注射水凝膠兩種應用形式。心肌補片是在開胸手術后通過自粘連或縫合將聚合物貼片或水凝膠固定在患者心臟表面。與心肌補片相比,經導管微創介入可注射水凝膠手術操作簡單、創傷小、對心臟功能恢復效果更好。目前,基于海藻酸鹽或細胞外基質的可注射水凝膠已進入臨床試驗階段。根據Laplace定律,壁應力與壁厚成反比,注射入心室壁的水凝膠可通過增加壁厚,減輕心室壁所受應力。基于可注射水凝膠主體,還可以在水凝膠中引入細胞或生物活性分子,以增強水凝膠促進心肌細胞再生、調節炎癥、增強血管生成或抑制受損心肌纖維化的能力。然而,目前的心衰治療水凝膠大多功能單一,不能完全滿足治療心衰這一復雜臨床綜合征的需求。因此,開發滿足心肌修復和心功能恢復各項要求的多功能可注射水凝膠仍是一大挑戰。目前針對心衰治療的前沿研究還包括機械人工心臟、細胞化或無細胞化的具有心臟天然結構的三維打印聚合物人工心臟和脫細胞人工心臟等。人工心臟的發展將有望緩解心臟供體嚴重不足的問題,滿足更多心衰患者對心臟移植的需求。
心臟封堵器
先天性心臟病主要是指新生兒或兒童因心臟發育異常所導致的心臟缺陷。在各類先天性心臟病中,腔壁或血管壁缺損是最為常見的結構性心臟缺陷,其在新生兒中的發病率接近1%,全球每年新增患者高達140萬例。先天性心臟病的常見類型包括室間隔缺損、房間隔缺損、動脈導管未閉和卵圓孔未閉等。經導管心臟封堵器無需進行開胸手術,是治療此類心臟結構性缺陷的最有效的方式。目前商業化的心臟封堵器由不可降解的鎳鈦合金網和聚合物阻流膜組成,將其植入人體后,因金屬材料永久殘留在心臟部位,有可能增加長期并發癥風險,如內皮化遲緩、血栓形成、磨損和穿孔,甚至出現致命的晚期房室傳導阻滯等。生物可降解封堵器是解決此類問題的最佳方案,其可作為臨時骨架引導心臟組織的再生,并在缺陷被新生組織替代后被人體組織逐漸吸收,最終恢復心臟功能重構。
人工血管
人工血管是冠狀動脈搭橋手術和動靜脈瘺管的有效替代品,其在心血管醫用材料領域占有重要的地位。人工血管的血液相容性和力學相容性是其植入后能否成功服役的一些關鍵因素。由聚對苯二甲酸乙二醇酯(PET)和膨體聚四氟乙烯(ePTFE)制備的大口徑人工血管(>6 mm)在臨床上已得到廣泛應用。然而,小口徑人工血管仍存在低血流速度導致的吻合處血栓形成和血管內膜增生等問題,難以滿足臨床需求。小口徑人工血管的開發仍面臨挑戰,科學家正在研究各種技術突破人工小血管研究面臨的瓶頸。從傳統材料到智能材料,從異種脫細胞材料到組織工程支架材料,從靜電紡絲制造到3D打印產品,目前科研工作者已為小口徑人工血管的研發開發了各種各樣的材料。不過迄今為止,所有人工血管都是通過外科手術方式植入的,未來這可能會成為其在臨床上廣泛應用的一個關鍵限制因素。因此,開發人工血管的微創植入技術是未來值得探索的一個方向。
結論
新型心血管材料和心血管微創介入技術的發展為心血管疾病的治療提供了強有力的解決方案。為尋求更優的治療方案,未來的進一步研究可遵循以下原則:①研發具有優異組織再生性能的心血管材料;②研發體積更小和性能更優的智能植入器械;③爭取為患者提供更多的智能或精確治療方案。在上述創新的基礎上,將會為心血管疾病患者提供更為先進和更加有效的治療方案。